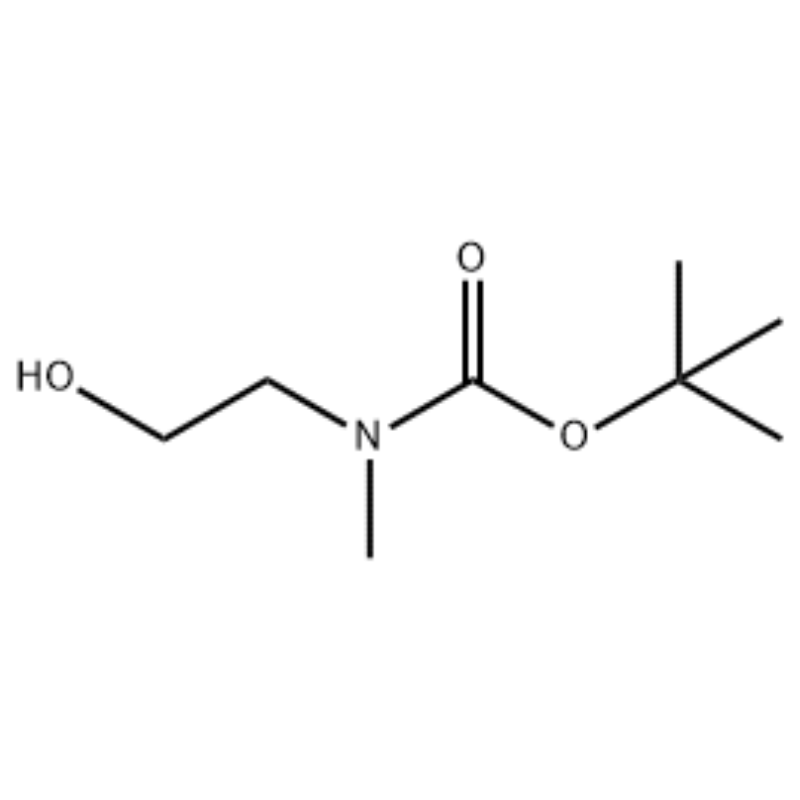
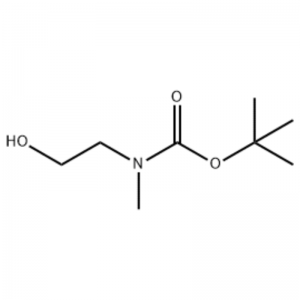
Aan een oplossing van 2-(methylamino)ethanol (500 mg, 0,53 ml, 6,66 mmol) in CH2C12 (20 ml) werd Boc2O (1,48 g, 6,79 mmol) toegevoegd, gevolgd door 1 uur roeren bij kamertemperatuur.De reactieoplossing werd geëxtraheerd met pekel en CH2C12.De aldus verkregen organische laag werd gedroogd boven MgS04 en gefiltreerd.Vervolgens werd het filtraat in vacuo geconcentreerd om de beoogde verbinding (kleurloze olie, kwantitatief) te verkrijgen;1H NMR (200 MHz, CDCl3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);massaspectrum m/e (relatieve intensiteit) 144 (20) 102 (24) 57 (70) 44 (100).
Voorbeeld 38;N1-(3-Fluor-4-(2-(1-(2-(methylamino)ethyl)-1H-imidazol-4-yl)thieno[3,2-b]pyridine-7-yloxy)fenyl)-N3 -(2-methoxyfenyl)malonamide (96);Stap 1: tert-Butyl-2-hydroxyethyl(methyl)carbamaat (97) (J. Med. Chem., 1999, 42, 11, 2008) Naar een oplossing van 2-(methylamino)ethanol (5,0 g, 67 mmol) in Aan THF (50 ml) bij kamertemperatuur werd Boc2O (15,7 g, 72 mmol) toegevoegd en het reactiemengsel werd 4 uur bij kamertemperatuur geroerd.Het reactiemengsel werd tot droog geconcentreerd en de titelverbinding 97 werd direct in de volgende stap gebruikt zonder extra zuivering (11,74 g, 100% opbrengst).MS (m/z): 176,2 (M+H).
Bereiding van l-2-[4-Bromo-2-(4-oxo-2-ftiotaioxo1hiazolidine-5-ylidenemefliyl)fenoxy]efliyl-3-efliyl-l-methylureum (Compoiotamd 161) Stap 1: Synthese van t-butyl2- hydroxyethylmethylcarbamaat;Aan een oplossing van 2-(methylamino)ethanol (500 mg, 0,53 ml, 6,66 mmol) in CH2C12 (20 ml) werd BoC2O (1,48 g, 6,79 mmol) toegevoegd, gevolgd door 1 uur roeren bij kamertemperatuur.De reactieoplossing werd geëxtraheerd met pekel en CH2C12.De aldus verkregen organische laag werd gedroogd boven MgS04 en gefiltreerd.Vervolgens werd het filtraat in vacuo geconcentreerd om de doelverbinding (kleurloze olie, kwantitatief) te verkrijgen; 1HNMR (200 MHz, CDCl3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);massaspectrum m/e (relatieve intensiteit) 144 (20) 102 (24) 57 (70) 44 (100).
2-(methylamino)ethanol (90,1 g, 1,2 mol) werd opgelost in 1,2 1 methyleenchloride en BoC2O (218 g, 1 mol) werd daaraan langzaam toegevoegd onder roeren bij 0°C, gevolgd door 3 uur bij kamertemperatuur.Het reactiemengsel werd achtereenvolgens gewassen met 700 ml van een waterige oplossing van verzadigd ammoniumchloride en 300 ml water.Het gewassen mengsel werd gedehydrateerd met behulp van watervrij natriumsulfaat en geconcentreerd onder verlaagde druk, waardoor verbinding (a) (175 g, 1 mol, 100%) werd verkregen als een olie zonder kleur. TLC: Rf = 0,5 (50% EtOAc in Hex) gevisualiseerd met Ce-Mo kleuring 1H NMR (600 MHz, CDCl3) delta 1,47 (s, 9H), 2,88 (br s, IH), 3,41 (br s, 2H), 3,76 (br s, 2H).
90,1 g (1,2 mol) 2-(methylamino)ethanol werd opgelost in 1,2 liter methyleenchloride, 218 g (1 mol) Boc2O werd daaraan langzaam toegevoegd terwijl de resulterende oplossing werd geroerd bij 0°C, en de resulterende oplossing werd geroerd bij kamertemperatuur gedurende 3 uur.Het reactiemengsel werd achtereenvolgens gewassen met 700 ml van een waterige verzadigde ammoniumchlorideoplossing en 300 ml water, gedehydrateerd met behulp van watervrij natriumsulfaat en vervolgens onder verminderde druk geconcentreerd, waardoor 175 g (1 mol) van een achromische olieverbinding werd verkregen, beschermd door de Boc-groep (rendement: 100%).1H NMR (600 MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H) 90 g (0,514 mol) van de verkregen verbinding werd opgelost in 1,5 1 tetrahydrofuran, 88,0 g (539 mol) N- hydroxyftalimide en 141 g (0,539 mol) trifenylfosfine werden daaraan toegevoegd, 106 ml (0,539 mol) diisopropylazodicarboxylaat werd daaraan langzaam toegevoegd terwijl de resulterende oplossing bij 0°C werd geroerd, en de resulterende oplossing werd 3 uur geroerd terwijl de temperatuur ervan werd verhoogd. tot kamertemperatuur.Na concentratie van het reactiemengsel onder verlaagde druk werd daaraan 600 ml isopropylether toegevoegd, de resulterende oplossing werd 1 uur bij 0°C geroerd en wit trifenylfosfineoxide van het vaste type werd gefiltreerd.De vaste stof werd gewassen met 200 ml isopropylether, gekoeld tot 0°C en verzameld met het eerste filtraat, en het resulterende filtraat werd geconcentreerd onder verminderde druk om 198 g van een mengsel van Verbinding XX en diisopropylhydrazodicarboxylaat te verkrijgen in een mengverhouding van 10 tot 15%. (rendement: 120%).1H NMR (600 MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H)
 Gebouw 12, nr. 309, South 2nd Road, economische ontwikkelingszone, Longquanyi District, Chengdu, Sichuan, China.
Gebouw 12, nr. 309, South 2nd Road, economische ontwikkelingszone, Longquanyi District, Chengdu, Sichuan, China. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404



















.png)


